第42章 弥散性血管内凝血
弥散性血管内凝血(disseminatedintravascular coaglation,DIC)是由多种原因引起的一种中间病理过程。血液先处于高凝状态,多部位的血管,特别是微血管内发生纤维蛋白沉积和血小板聚集,因此称之为DIC。随着凝血过程的发展,凝血因子和血小板被大量消耗,同时继发纤维蛋白溶解亢进(简称溶纤),导致低凝状态而发生多部位出血,因此本病又称为消耗性凝血障碍或去纤维蛋白综合征。
第一节 病因
一、感染
各种感染是DIC的主要原因之一,约占30%左右。其中以革兰阴性杆菌所致的严重感染最为多见,如败血症、胆道感染、泌尿道感染、伤寒、中毒性菌痢等。革兰阴性球菌脑膜炎双球菌所致的暴发性流行性脑脊髓膜炎,以往曾称为Waterhouse-Frideriehsen综合征,亦即急性肾上腺皮质功能衰竭综合征,重症流行性出血热、肝炎、麻疹、水痘等病毒感染及疟疾也是诱发DIC的重要原因。
二、恶性肿瘤和急性白血病
所占比例与感染相近。恶性肿瘤并发DIC主要见于消化道的各种粘液腺癌,大多发生于已有广泛转移的晚期病人。急性白血病中以急性早幼粒细胞白血病占首位,临床上十分常见。
仅次于上述两种病因,约占DIC的5%~10%。胎盘早期剥离、羊水栓塞、死胎滞留、先兆子痫、败血性流产、产后重症感染及羊水内注药引产等为常见原因。
四、手术和创伤
所占比例和产科并发症近似。胸腔手术、体外循环、人工心脏瓣膜置换及器官移植等大型手术,大面积烧伤和严重的挤压伤综合征等为常见原因。
五、肝病
暴发性肝炎、亚急性肝坏死和肝硬化等严重肝病的全身性出血常和DIC有关。
六、其他
严重的输血、输液反应,肺原性心脏病、急性坏死性胰腺炎、急性坏死性肠炎、某些结缔组织病、药物过敏、毒蛇咬伤及中暑等都可能诱发DIC。
第二节 发病机理
DIC的发病机理分下列四方面阐述(图42-1)。
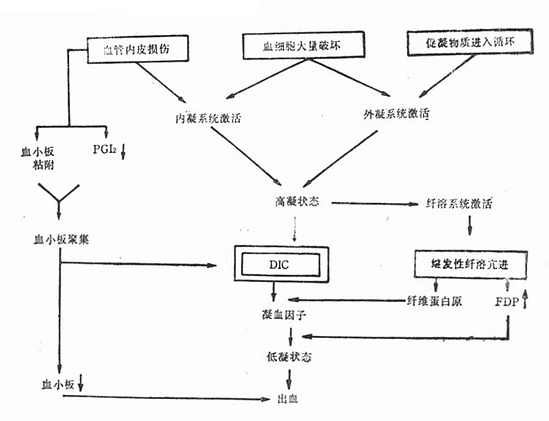
图42-1 DIC发生机理
一、血管内皮损伤
细菌及其毒素、病毒及其代谢产物、抗原抗体复合物、长时间休克、缺氧及酸中毒等均可导致血管内皮损伤,使基底膜胶原纤维暴露,从而激活因子Ⅻ,继而启动内源性凝血系统;同时损伤的血管内皮可释放组织因子,激发外源性凝血系统。内、外源泉凝血系统激活的共同后果为循环内生成凝血酶,使纤维蛋白原变为纤维蛋白,即红色血栓,造成血管内凝血。此外,血管内皮广泛损伤使前列环素(PGI[XB]2[/XB])合成减少,有利于血小板聚集,形成白色血栓。
二、组织促凝物质及其他促凝物质进入循环
孕期宫腔内容物(羊水、胎盘组织、死胎等)、大量组织损伤(大面积烧伤、严重外伤及大手术等)所释放的组织因子均为强烈的组织促凝物质。肿瘤细胞、放疗及化疗后肿瘤或白血病细胞破坏时所释放的内容物,革兰阴性杆菌的内毒素及胰酶等均为促凝物质,具有组织因子的活性。上述物质都可启动外源性凝血系统。
三、血细胞大量损伤
各种原因引起的严重溶血(如血型不合的溶血性输血反应、药物过敏、自家免疫、溶血尿毒症综合征等),由于红细胞大量破坏释放红细胞素;血小板大量破坏(如急性血栓性血小板减少性紫癜、人工心脏瓣膜、药物过敏、自家免疫等)所释放的磷脂;白细胞大量破坏(如某些严重感染引起的急性粒细胞减少或缺乏)所释放的溶酶体酶。上述三种血细胞的释放物都具有强烈的促凝活性,可激活内、外源凝血系统。
四、继发性纤溶亢进
这是机体的一种保护性代偿机能。实际上在DIC初期就开始了纤溶过程。激活的因子Ⅻ、生成的凝血酶、纤维蛋白在血管壁的沉积,受损的组织或血管内皮细胞释放的纤溶酶原活化素等,都能使纤溶酶原变为纤溶酶。纤溶酶为一种蛋白分解酶,可溶解纤维蛋白。当纤溶酶浓度进一步增高时,也可溶解纤维蛋白原、因子Ⅴ、因子Ⅷ。纤维蛋白及纤维蛋白原经纤溶酶消化先后形成碎片X、Y、D、E,称之为纤维蛋白(原)降解产物(FDP)。FDP能干扰纤维蛋白单体的聚合,对抗凝血酶及影响凝血活酶的生成,干扰血小板聚集,故FDP具有强烈的抗凝作用。
继发性纤溶亢进加之大量凝血因子及血小板在DIC过程中的消耗,使血液由高凝状态逐渐转为低凝状态。
上述DIC的发病机理在一个具体病人中往往为多种原因、多种机制同时相互作用,其过程极为复杂。
下列因素常有利于DIC的发生、发展。①血浆凝血因子及血小板数增加:故孕妇分娩时易发生高凝状态,其中一部分孕妇如并发产科合并症则可导致DIC;②纤溶活性减低:如激素可抑制纤溶活性;③单核-巨噬细胞系统阻滞:长期应用肾上腺皮质激素、脾切除及肝功能障碍时该系统功能减低,循环中形成的纤维蛋白,进入循环的促凝物质及已被激活的凝血因子不能及时清除,易于发生血管内凝血;④血流淤滞:心力衰竭、应用α肾上腺能药物、巨大血管瘤等可使全身或局部血流淤滞,有利于血管内凝血的发生。
第三节 病理生理
一、血栓形成及相应的脏器功能衰竭
内、外源凝血系统的激活及血小板聚集的结果是微血管内形成广泛的血栓,即为DIC的本质。微血栓形成的部位以肺、肾、肝、脑、皮肤、心及肾上腺等器官最易累及。受累的器官由于微血管内广泛血栓形成,血液灌注明显减少,必然发生功能障碍,直至功能衰竭。其中以急性肾功能衰竭最为常见,病理上可见肾小球入球动脉及毛细血管内有微血栓形成,肾小管广泛缺血、间质水肿,严重者有肾皮质坏死。急性呼吸功能衰竭也较为多见,镜检可见肺毛细血管广泛微血栓形成,伴点状出血及肺水肿,加之此时肺动-静脉短路开放,肺动脉血流未经气体交换直接经短路进入肺静脉,造成明显缺氧。肝内微血管广泛血栓形成可发生肝点状坏死、出血及肝功障碍。肾上腺皮质受累时,由于出血和坏死造成急性肾上腺皮质功能不全。
部分病例尸检时找不到微血栓,可能由于DIC晚期以纤溶为主,已将微血栓溶解;也可能由于死后微血栓已自溶。
二、微循环衰竭
DIC时发生微循环衰竭的原因为:①回心血量明显减少:微循环内广泛血栓形成使循环受阻,回心血量减少,心搏量随之减少,导致微循环灌注不足。②血管活性物质释放:因子Ⅻ及纤溶酶可使循环中的激肽释放酶原变为激肽释放酶,后者进一步使激肽原转变为缓激肽。缓激肽是一种强烈的舒张血管的活性物质,使全身小血管扩张,血浆渗出,有效循环血量减少。纤溶产生的FDP也可增加血管壁的通透性,加重血浆渗出。此外,纤维蛋白原转变为纤维蛋白过程中,裂解出的纤维蛋白肽A(FPA)及肽B(FPB)以及循环中生成的凝血酶,都可引起血管痉挛,进一步加重微循环灌注不足。③心功能障碍:心肌微血管受累可影响心肌功能,降低心排血量,甚至发生心源性休克。④出血:DIC后期以低凝状态为主时,可发生广泛的出血而进一步降低血容量。
一旦发生微循环衰竭,由于严重的组织缺氧,酸中毒及血流淤滞等可加重DIC,造成恶性循环。
三、出血
由于广泛的血管内凝血,消耗了大量的凝血因子,如纤维蛋白原、因子Ⅱ、Ⅴ、Ⅷ、Ⅻ、ⅩⅢ 同时也消耗了大量血小板;纤溶系统启动后,如发生继发性纤溶亢进,将使纤维蛋白原及因子Ⅴ、Ⅷ等进一步减少;纤溶中形成的FDP的抗凝效应无疑将加重血液的低凝状态。上述三方面病理变化的共同结果可引起严重的全身性出血。
四、微血管病性溶血
DIC时血管内形成的广泛微血栓及某些血管活性物质释放使微血管管径变窄,红细胞难以通过,或勉强通过时遭机械性损伤而发生变形、破裂,直至溶血。如溶血发生迅速,程度严重,超过骨髓代偿能力,即可产生与出血不成比例的贫血——微血管病性溶血性贫血。溶血时红细胞释放的红细胞素等促凝物质又可加重DIC。
第四节 临床表现
一、与血栓形成有关的表现
血栓形成可发生在皮肤等浅表部位,也可发生在内脏。前者临床常见的有肢端、鼻尖、耳垂等部位发绀、疼痛,严重时上述部位可见坏死。常见发生于内脏的血栓形成有①肾:肾微血管内血栓形成十分常见,临床表现为少尿、无尿、恶心、呕吐,实验室检查血尿素、肌酐、钾等明显升高,血pH值降低,发生氮质血症、代谢性酸中毒及高钾血症,形成急性肾功能衰竭。凡临床上遇有原因不明的急性肾功能衰竭,应考虑到DIC的可能。②肺:肺微血管内血栓形成使肺泡渗出增加,甚至肺水肿。临床表现为气短、胸闷、紫绀,严重者可出现明显的呼吸困难及意识障碍。血气分析示PO[XB]2[/XB]降低,PCO[XB]2[/XB]升高。肺部X线检查可见弥散性浸润阴影。部分患者可因急性呼吸功能衰竭而死亡。③肝:肝内微血管血栓形成可表现为肝肿大、黄疸、转氨酶升高等肝功异常。肝功能损害可影响凝血因子的合成,加重出血倾向。④脑:脑微血管血栓形成及随后伴发的脑灶性出血、水肿可出现嗜睡、烦躁及意识障碍,重者可有抽搐、肢体瘫痪、昏迷。偶而可发生大血管血栓形成,脑动脉、肺动脉、肢体动脉或静脉均可累及,临床可出现上述部位类似动脉栓塞或静脉血栓形成的症状和体征。
二、休克
约有半数的病人发生休克,且大多发生在DIC早期。其临床表现和其他原因引起的休克基本一致,但DIC引起的休克多甚顽固,常规的抗休克治疗往往难以奏效。临床上遇有原因不明的顽固性休克,需想到DIC的可能。
三、出血
出血可见于大部分DIC病人,且多数出现在凝血因子、血小板已大量消耗的低凝期,如已进入纤溶亢进期,出血倾向更为明显。出血的特征为皮肤大片深紫色瘀斑及注射部位渗血,特别是以注射点为中心的出血性斑丘疹较为特殊。切口渗血不止和血不凝,分娩和产后出血不止也颇为多见。上述类型的出血往往是DIC的信号,应引起临床医生的警惕。此外,DIC时也可发生鼻衄、牙龈出血、咯血、呕血、便血及尿血,如发生颅内出血可迅速致死。遇有不易用原发病解释的、突然发生的多部位出血,要考虑DIC的可能。
必须指出,在DIC早期的高凝阶段可无出血症状,如此时即进行积极治疗,则整个病程中可始终无出血表现;某些起病急骤的重症DIC,可因顽固性休克或重要脏器功能衰竭而迅速死亡,也可无出血症状;少数亚临床型患者当然更无出血症状。故出血并非是诊断DIC的必不可少的条件。
四、溶血与贫血
微血管病性溶血可见于部分DIC患者。临床表现为黄疸及与出血程度不相平行的贫血。实验室检查示血间接胆红素增高,血红蛋白下降及网织红细胞升高。更为有意义的是周围血涂片上出现红细胞片和变形红细胞,若超过红细胞总数的2%,即有实验室诊断意义。此外,仅有黄疸而无贫血时,需和DIC所致的肝损害及原有的肝胆疾病相鉴别。部分病人贫血和溶血无关,可能和并存的出血或原发病有关。
DIC是一种由多种疾病引起的中间病理过程。病情的轻重缓急又不一致,因此不同的病人临床表现颇为悬殊。但一般急性DIC至少会有两种临床表现:在发病早期的高凝阶段,以休克及血栓形成引起脏器功能障碍为主要表现;在凝血因子、血小板消耗后及纤溶亢进期,出血常成为突出的问题。亚急性和慢性DIC主要表现为出血,休克及脏器功能障碍较少见,部分慢性DIC可无症状,仅通过实验室检查才证实,故又称之为亚临床型。
第五节 实验室检查
一、血小板质与量的改变
(一)血小板计数 DIC时血小板明显减少者占90%以上,有人认为若血小板数正常,DIC的诊断几乎难于成立。故此项简单的实验室检查具有很大的实用价值。必须强调指出,动态观察血小板计数更有意义。凡有可能发生DIC的病人,应立即进行血小板计数,为以后的变化作对照。因为某些患者的血小板数在正常值的高限,发生DIC后虽有明显下降,但仍在正常值的低限以上而造成判断错误。应该注意的是白血病、肝病患者的血小板数在发生DIC前,已明显减少,因此这一指标失去了判断意义。
(二)血小板激活的分子标志的测定 近年来研究发现,血管内皮损伤、免疫复合物、凝血酶等可刺激和激活血小板,并释放激活物质,如β血栓球蛋白(β-TG)、血小板第4因子(PF[XB]4[/XB])、血栓素A[XB]2[/XB]和B[XB]2[/XB](TXA[XB]2[/XB]、TXB[XB]2[/XB])等,称之为血小板激活的分子标志。目前临床已可应用放射免疫法测定β-TG、PF[XB]4[/XB]和TXB[XB]2[/XB],以此作为体内高凝状态的敏感指标,DIC时均有明显的升高。血浆正常值,β-TG为20~40μg/L,PF[XB]4[/XB]为10~20μg/L,TXB[XB]2[/XB]为0~5ng/L。
二、反映凝血因子消耗的检查
(一)凝血时间 可反映内源性凝血过程中各凝血因子的综合水平。可选用试管法和复钙法,玻片法影响因素甚多,已无使用价值。在DIC早期的高凝阶段,凝血时间可明显缩短,有时在抽血过程中血液即迅速凝固,此对诊断早期DIC有很大价值。随着凝血因子的消耗及纤溶亢进,凝血时间逐渐延长。
(二)激活的部分凝血活酶时间(APTT) 也反映内源性凝血过程中各凝血因子的综合水平。白陶土部分凝血活酶时间(KPTT)的意义和APTT相似,DIC时大部分有不同程度的延长。在DIC早期APTT和KPTT也均可缩短。
(三)凝血酶原时间(PT) 反映外源性凝血过程中各凝血因子的综合水平。DIC时90%以上有不同程度的延长,但部分病例早期可正常,甚至缩短。
(四)纤维蛋白原 DIC早期常正常,部分亚急性或慢性DIC患者纤维蛋白原的消耗和合成可大致平衡,无明显减少。故只有一部分DIC病人降低,不是一个敏感的指标,尤其不能用于早期诊断。
(五)因子Ⅷ测定 DIC时因子Ⅷ中的凝血活性部分,即Ⅷ:C常明显降低,而因子Ⅷ抗原部分,即VWF:Ag常正常,甚或升高,故Ⅷ:C/VWF:Ag比值明显降低。
三、反映循环中有凝血酶作用于纤维蛋白原的检查
内、外源凝血系统激活的共同结果是在循环中形成凝血活酶,使凝血酶原变为凝血酶,随后凝血酶即作用于纤维蛋白原,形成纤维蛋白单体并先后释放出FPA和FPB。如能从循环中检出FPA或FPB以及检出纤维蛋白单体,则可有力地证实已有血管内凝血。目前已能用放射免疫法测定FPA和FPB。已普遍使用的副凝试验可检出纤维蛋白单体,其原理为纤维蛋白单体遇早期FDP碎片X可结合成可溶性复合物,如加入鱼精蛋白,复合物可迅速析出纤维蛋白单体,聚合为絮状物。这种不经凝血酶的作用而发生的凝聚现象称为“副凝”。在血浆中加入鱼精蛋白检测有无纤维蛋白单体的试验即血浆鱼精蛋白副凝试验(plasma protamine paracoagulation 3P试验)。DIC晚期由于纤维蛋白原大量消耗,纤维蛋白单体失去来源,同时血浆中以晚期FDP碎片Y、D、E为主,碎片X极少,故3P试验呈阴性。此外,虽3P试验在DIC早期较为敏感,但凡有血管内凝血,而不一定是DIC,3P试验均可阳性,故其特异性较差。
测定出循环中有纤维蛋白单体或纤维蛋白肽A、B存在,表示已有凝血酶生成,目前尚不能直接从循环中测定凝血酶,但已知凝血酶原在凝血活酶作用下首先分裂出碎片1、2,生成中间体Ⅱ,中间体Ⅱ再经凝血活酶作用生成凝血酶。故如从循环中测得碎片1、2,实际上反映了循环中有凝血活酶生成,同时已形成凝血酶,提示血管内凝血已开始,据此可用于诊断DIC的存在。目前已可用放射免疫法等测定之。
四、反映继发性纤溶亢进的检查
局部纤溶和全身性纤溶亢进时都可从血浆中检出FDP,上述的3P试验除证实循环中存在纤维蛋白单体外,一般也可间接反映有FDP存在。目前常用的直接检测循环中FDP的方法如下。
(一)葡萄球菌猬集试验 含有FDP碎片X的血浆可使凝固酶阴性的金黄色葡萄球菌(Newmen D[XB]2[/XB]株)猬集,可根据猬集的程度来推测FDP的含量。
(二)FDP免疫测定 目前应用较多的有鞣酸红细胞血凝抑制试验及乳胶颗粒凝集试验。
(三)凝血酶时间 如肝素治疗前测定可反映血浆纤维蛋白原和FDP水平;如纤维蛋白原水平正常或测定时加入一定量纤维蛋白原于受检血浆中,则可间接反映FDP水平。
五、测定有无全身性纤溶亢进的检查
(一)优球蛋白溶解时间 优球蛋白是血浆在酸性环境中可析出的蛋白质成分,包括纤维蛋白原、纤溶酶原及其活化素,但不含纤溶抑制物。使上述蛋白溶解后加入凝血酶或钙即生成纤维蛋白凝块,此时含在凝块中的纤溶酶原被其活化素激活成纤溶酶,在37℃下观察凝块的溶解时间可间接了解全身性纤溶活性。正常应大于90min,DIC时明显缩短。本试验操作简单,1~2h可出结果,但阳性率仅30%~40%,一般在DIC晚期才有阳性结果,因此不能用于早期诊断。
(二)纤溶酶原定量测定 正常血浆中含有丰富的纤溶酶原,DIC时被活化素活化,纤溶酶原转变成纤溶酶,含量明显降低。受检血浆加入活化素(链激酶)使纤溶酶原变为纤溶酶,再以酷氨酸为底物测定其纤溶活性,正常值为0.7~1.2g/L。
(三)肽段β[XB]1[/XB][XB]~42[/XB]及β[XB]15[/XB][XB]~42[/XB]测定 纤溶酶作用于纤维蛋白可释放出肽段β[XB]1[/XB][XB]~42[/XB]及β[XB]15[/XB][XB]~42[/XB],纤溶酶作用于纤维蛋白原,则释出肽段β[XB]1[/XB][XB]~42[/XB]及β[XB]1[/XB][XB]~118[/XB]。故如血浆中β[XB]1[/XB][XB]~42[/XB]及β[XB]15[/XB][XB]~42[/XB]等含量增加可反映纤溶活性增强。有人提出如单纯β[XB]1[/XB][XB]~42[/XB]、β[XB]15[/XB][XB]~42[/XB]增多,而无FPA、FPB增多则为原发性纤溶,如两类物质同时增加则为DIC伴发的继发性纤溶亢进,据此可鉴别原发性纤溶和DIC。
第六节 诊断和鉴别诊断
10余年来国内外先后制定了不同的DIC诊断标准,如著名的Colman诊断标准曾被广泛采用,但只有实验室指标,缺乏原发病及临床方面的标准,仍失之全面,根据此标准易将非DIC误诊为DIC。国内在1982年的全国血栓与止血会议上制定的诊断标准,经几年的试用证明基本上适合我国的国情。1986年首届中华血液病学会全国血栓与止血学术会议对1982年诊断标准中的实验室检查部分作了部分修正,使之更适用于我国的临床实际。现附该诊断标准于后。
(一)存在易于引起DIC的基础疾病
(二)有下列两项以上临床表现 ①多发性出血倾向;②不易用原发病解释的微循环衰竭或休克;③多发性微血管栓塞症状、体征,如皮肤、皮下、粘膜栓塞坏死,及早期出现的肾、肺、脑等脏器功能不全;④抗凝治疗有效。
(三)实验检查有下列三项以上异常 ①血小板低于100×10[SB]9[/SB]/L或呈进行性下降(肝病DIC低于50×10[SB]9[/SB]/L)。②纤维蛋白原低于1.5g/L或进行性下降,或高于4g/L(肝病DIC低于1g/L)。③3P试验阳性或FDP高于200mg/L(肝病DIC高于600mg/L)。④凝血酶原时间缩短或延长3s以上,或呈动态性变化,或APTT缩短或延长10s以上。⑤优球蛋白溶解时间缩短,或纤溶酶原降低。⑥疑难、特殊病例应有下列1项以上实验异常:因子Ⅷ:C降低,VMF:Ag升高,Ⅷ:C/VWF:Ag比值降低;AT-Ⅲ含量及活性减低;血浆β-TG或TXB[XB]2[/XB]升高;血浆纤维蛋白肽A(FPA)升高或纤维蛋白原转换率增速;血栓试验阳性。
最易与DIC混淆的疾病是伴有全身性出血的重症肝病,因为重症肝病可因凝血因子合成减少及可能同时存在的血小板减少而发生多部位的出血。但重症肝病也可诱发DIC。目前要将两者清楚地加以鉴别尚有许多困难,下列几点更倾向于DIC的存在,而非由于肝病本身所致的出血。①突然发生的休克;②有皮肤、肺等脏器的微血管内血栓形成的有关临床表现;③Ⅷ:C/VWF:Ag比值降低(单纯肝病时,Ⅷ:C及VWF:Ag可升高或正常,比值不变);④3P试验阳性;⑤FPA、FPB升高;⑥血小板激活的分子标志如β-TG、PF[XB]4[/XB]及TXB[XB]2[/XB]升高。
第七节 治疗
一、病因治疗
及时去除病因是治疗成败的关键。临床经验证明,凡是病因能迅速去除或控制的DIC,预后较好,如部分产科意外诱发的DIC,往往在胎儿及胎盘娩出后,未经抗凝治疗即获痊愈;某些感染触发的DIC,经积极控制感染、纠正休克、水电解质及酸碱平衡后,DIC即可消失。相反,多数恶性肿瘤或白血病引起的DIC虽使用肝素及其他多种措施,DIC仍难以控制,或仅获暂时效果,不久又再度恶化。
二、抗凝治疗
(一)肝素的应用 肝素抗凝的药理机制是肝素与AT-Ⅲ首先结合,使AT-Ⅲ构型改变,活性大大增加,继而灭活凝血酶及激活的因子Ⅹ。故肝素的抗凝作用在一定程度上受到体内的AT-Ⅲ水平和活性的影响。
近年来国内、外某些作者对肝素的应用提出异议,有报告肝素治疗组的病死率并不低于非肝素治疗组;一部分DIC患者尸检时无微血栓形成的证据,认为肝素治疗无益,甚至会加重出血。我们自己的尸检材料和临床治疗结果表明,DIC的基本病理变化仍是广泛的血管内凝血,临床应用肝素在部分病例中确有疗效,因此肝素仍应作为治疗DIC的一种有效措施供临床谨慎使用。部分病例肝素治疗失败,可能和以下因素有关。①原发病太重或DIC来势过猛,肝素未发挥作用前患者就因休克或重要脏器功能衰竭而死亡,因为肝素只能阻止血管内凝血的进展,对已形成的血栓无清除作用;②使用时机掌握不当,如DIC已进入纤溶亢进期,血栓形成不是主要矛盾,此时单独使用肝素反可加重出血;③酸中毒未及时纠正,可影响肝素的活性;④患者血浆中AT-Ⅲ含量过低,或PF[XB]4[/XB]水平过高;⑤剂量过小或超量使用。
鉴于应用肝素有可能加重出血的弊端,必须严格掌握适应证;①基本病因短期内不能去除的严重急性DIC,尤其是感染所致者;②需补充血小板、凝血因子或使用纤溶抑制剂时,但又不能肯定体内凝血过程是否已中止,可同时或提前使用肝素;③慢性、亚急性DIC,肝素疗效较好,值得选用。在应用肝素的同时,应采取综合治疗措施,为肝素治疗创造良好的条件。已有颅内出血及DIC晚期以纤溶亢进为主时禁用肝素。肝病引起的DIC、有血管损伤或新鲜创面和切口的病人、肺结核空洞和溃疡病患者应慎用。
肝素的剂量应因人而异。一般首次用量为0.5~1mg/kg,每4~6h给一次维持量,维持量一般为0.25~0.5mg/kg。具体应根据试管法凝血时间的测定来监护肝素用量,使凝血时间控制在20~30min,如小于20min,可酌情加量;大于30min,应及时减量或停用。同时严密观察临床病情进展和有无出血加重的倾向。我们在实际应用中往往选用较上述更小的剂量而奏效。急性DIC一般需持续治疗3~5天,当临床上出血基本停止、休克纠正、急性肾功能衰竭等血栓形成表现得以恢复,即可开始减量,2~3天内完全停用。实验室检查结果也可作为减量和停药的参考。如病因尚未去除,应适当延长使用时间,停用后必须密切追查,注意有无复发。慢性和亚急性DIC一般每12~24h给药一次即可,疗程往往较长,根据出血好转和实验室检查结果逐渐减量和停药。
(二)血小板聚集抑制剂 血小板聚集形成白色血栓只是DIC的一个组成部分,因此血小板聚集抑制剂难以逆转整个DIC过程,一般应和肝素同时使用。如短期内病因能去除的轻型DIC及DIC基本控制,已停用肝素的患者也可单独应用。
常用的血小板聚集抑制剂为潘生丁,它通过抑制血小板内磷酸二酯酶,提高血小板环磷酸腺苷的浓度而抑制血小板聚集。潘生丁同时通过抑制血小板TXA[XB]2[/XB]合成酶,阻止TXA[XB]2[/XB]合成,从而减弱血小板聚集,影响血小板释放反应和血管收缩。潘生丁剂量为每日400~800mg,静脉滴注。本药副作用小,使用安全。
低分子右旋糖酐也有抑制血小板聚集的作用,同时具有扩充血容量、降低血液粘稠度、保护血管壁的光滑完整、阻止红细胞聚集等作用。每日用量为500~1500ml,静脉滴注。
(三)抗凝血酶Ⅲ 当患者体内AT-Ⅲ水平明显低下时,可影响肝素的抗凝作用,此时如同时补充AT-Ⅲ,可取得满意的疗效。
三、溶栓治疗
在血管内凝血启动的同时,体内即开始了纤溶过程,这是机体为维持微循环畅通的一种保护机能,所以一般无需溶栓治疗。但当微血栓所致的顽固性休克和(或)重要脏器功能衰竭,而包括肝素在内的各种治疗无效时,值得试用纤溶激活剂。纤溶激活剂使纤溶酶原转变为纤溶酶,溶解已形成的血栓,疏通微循环,恢复组织灌注及重要生命器官的功能。
以往常用的溶栓药物为链激酶和尿激酶。链激酶有引起过敏反应及易抗药的缺点,目前,已很少应用。尿激酶有30%的患者发生程度不一的出血性并发症,因此剂量必须个体化,并应以凝血酶时间及FDP测定来监护。一般每日用量为20万~40万u,静脉滴注。
组织纤溶酶原激活剂(tissue-typeplasmogen activator,t-PA)对纤维蛋白具有高度的亲和性,其对纤溶酶原的激活在纤维蛋白表面进行,而对循环中的纤溶酶原及凝血因子无影响,所以大大减少了出血性并发症;同时t-PA无变态反应,故远较链激酶和尿激酶安全,目前已开始应用于临床治疗各种血栓栓塞性疾病。剂量为1000u/(kg·次)。当DIC已进入低凝阶段,甚至以纤溶为主时,理应禁用。
四、纤溶抑制剂的应用
纤溶抑制剂可抑制纤溶酶原激活剂的形成,从而使纤溶酶生成减少,降低机体的纤溶活性,大剂量时尚可直接灭活纤溶酶。纤溶抑制剂在DIC早期的高凝阶段忌用,因可加重微血管内的血栓形成,导致DIC恶化。故纤溶抑制剂只适用于DIC的消耗性低凝血期及继发性纤溶亢进期,如此时不能肯定血管内凝血是否已中止,应与肝素合用。
常用制剂有①抗血纤溶芳酸(PAMBA),又名对羧基苄胺,用量为每日400~800mg,静脉滴注;②凝血酸,又名止血环酸,每日500~1000mg,静脉滴注;③抑肽酶,除抑制纤溶外尚能抑制凝血活酶生成及对抗因子X,故可阻止血管内凝血发展,剂量为每日8万~10万u,静脉滴注。
五、血小板及凝血因子的补充
DIC时大量血小板及凝血因子在微血管内血栓形成过程中被消耗,因此,对有明显出血倾向及需手术治疗的患者。应在病因治疗和充分抗凝治疗的基础上补充适量的血小板和凝血因子,一般应同时给予肝素治疗。必须指出,贮存1周以上的库血含血小板及凝血因子很少,加之血细胞破坏后可释放出各种促凝及纤溶物质,故不宜应用。无贫血的病人,原则上不应输全血,输新鲜血浆即可,其中也含有较多的血小板。有时需补充血小板悬液,1个单位血小板(含1×10[SB]11[/SB]血小板)约可使血小板数增加10×10[SB]9[/SB]/L左右。纤维蛋白原应慎用,因其传播肝炎的可能性较输血浆高32倍以上。
六、明上腺皮质激素的应用
在DIC时是否用尚有争论。它具有抗炎、抗休克、抗过敏及减低血管通透性等作用,因而有利于改善微血管灌注,增加机体抗内毒素能力及止血功能。在华-佛综合征时尚有替代治疗的效能。但另一方面它保护溶酶体膜,纤溶酶原不易激活,一定程度上抑制了纤溶;长期应用可阻滞单核-巨噬细胞系统,阻碍纤维蛋白及被激活的凝血因子的清除,故可加重DIC。鉴于上述原因,在内毒素休克,急性肾上腺皮质功能衰竭综合征、出血倾向明显及DIC晚期以纤溶为主时,可短期应用,其他情况下应慎重。
对在急诊中已确诊而急需治疗的DIC患者,可根据具体情况给予相应的紧急处理。处于高凝期的病人首选肝素;已进入低凝期伴明显出血倾向者应补充凝血因子和血小板,也可根据实验室检查结果酌情应用纤溶抑制剂;对尚不能确定血管内凝血是否已中止者,则应同时加用小剂量肝素治疗。总之,高度个体化是治疗DIC的基本原则。
(单渊东 张之南)
参考文献
[1] 邓家栋主编:临床血液学,上海科学技术出版社,上海,1985
[2]沈迪、宋善俊主编:弥散性血管内凝血,上海科学技术出版社,上海,1985
[3] 陈娟:DIC的若干进展。国外医学内科学分册1984;11:234
[4]Nossel HL:Relativeproteolysis of the fibrinogen B Chain by thrombin and plasmin as a determinentof thrombosis. Nature 1981;291:165
[5]Feinstein DI: Diagnosis and management of DIC:The role of heparin therapy.Blood1982;60:284
[6]Colman RW:DIC-An approach review.Am J Med 1972;52:679
[7]单渊东等:播散性血管内凝血的诊断和治疗。中华内科杂志。1983:22:512